| هلیکوباکتر پیلوری | ||
|---|---|---|
 |
||
| طبقه بندی | ||
| دامنه : | باکتری | |
| فیلو : | سودومونادوتا | |
| کلاس : | اپسیلون پروتئوباکتری | |
| سفارش : | کمپیلوباکترال ها | |
| خانواده : | هلیکوباکتراسه | |
| جنسیت : | هلیکوباکتر | |
| گونه ها : | هلیکوباکتر پیلوری (Marshall et al. 1985) Goodwin et al. 1989 |
|
هلیکوباکتر پیلوری یک باکتری گرم منفی به شکل باسیل مارپیچ است (نام هلیکوباکتر از این ویژگی مورفولوژیکی گرفته شده است ) که در اپیتلیوم معده انسان زندگی می کند . عفونت هلیکوباکتر پیلوری می تواند باعث التهاب مخاط معده شود که می تواند منجر به تولید گاستریت ، زخم معده و لنفوم بافت لنفاوی مرتبط با مخاط (MALT) شود . با این حال، افراد آلوده ممکن است هرگز علائمی را نشان ندهند. این باکتری منحصراً در معده انسان زندگی می کند. به دلیل شکل مارپیچی خود، می تواند به معنای واقعی کلمه خود را “پیچ” کند تا اپیتلیوم معده را مستعمره کند، علاوه بر آن اوره آزی که به آن اجازه می دهد محیط اسیدی خود را خنثی کند. 1 2
منشأ نام
این باکتری در ابتدا Campylobacter pyloridis نامیده شد ، سپس Campylobacter pylori (زمانی که دستور زبان لاتین اصلاح شد ) و در سال 1989 پس از تعیین توالی DNA آن . مشخص شد که متعلق به جنس کمپیلوباکتر نیست و به سرده هلیکوباکتر منتقل شده است . نام پیلوری از لاتین pylorus به معنای “سد” گرفته شده است و به پیلور (دهانه دایره ای معده که به دوازدهه منتهی می شود ) اشاره دارد.
تاریخچه [ ویرایش ]
اولین شواهد [ ویرایش ]
در سال 1875 ، دانشمندان آلمانی باکتری های مارپیچی را در اپیتلیوم معده انسان کشف کردند . این باکتری ها قابل کشت نبودند و در نتیجه این کشف در آن زمان فراموش شد. 3 در سال 1892، محقق ایتالیایی ، جولیو بیزوزرو، مجموعهای از باکتریهای مارپیچی را توصیف کرد که در محیط اسیدی معده سگها زندگی میکردند.
پروفسور Walery Jaworski از دانشگاه Jagiellonian در کراکوف ، رسوبات شستشوی معده را که از انسان در سال 1899 بدست آمده بود، بررسی کرد . این محقق برای اولین بار پیشنهاد مشارکت این میکروارگانیسم در بیماری های معده را داد. اگرچه این اثر در کتاب راهنمای بیماری های معده گنجانده شد ، اما تأثیر زیادی نداشت، زیرا به زبان لهستانی نوشته شده بود . 4
بازیابی و شخصیت پردازی
این باکتری در سال 1979 توسط پاتولوژیست استرالیایی رابین وارن دوباره کشف شد که در تحقیقات بعدی (شروع از سال 1981) به همراه بری مارشال این میکروارگانیسم را از غشای مخاطی معده انسان جدا کردند و اولین کسی بود که آن را پرورش داد. در کار اصلی، وارن و مارشال بیان کردند که بسیاری از زخمهای معده و ورم معده در اثر کلونیزاسیون معده توسط این باکتری ایجاد میشوند، نه استرس یا غذای تند، همانطور که تا آن زمان حفظ میشد. 6
دخالت در پاتوژنز
جامعه پزشکی اخیراً متوجه این واقعیت شده است که این باکتری عامل زخم معده و ورم معده است ، زیرا اعتقاد بر این بود که باکتری ها نمی توانند برای مدت طولانی در محیط اسیدی معده زنده بمانند. جامعه بر اساس مطالعات بعدی که دوباره این ایده را تایید کرد، شروع به تغییر نظر کرد، از جمله مطالعهای که در آن مارشال کشت هلیکوباکتر پیلوری را نوشید ، به گاستریت مبتلا شد و باکتریها را از پوشش معده خود بازیابی کرد. با این کار، او 3 فرض از 5 فرض کخ را برآورده کرد . گاستریت مارشال به لطف درمانی که خود آنها بر پایه بیسموت با آنتی بیوتیک ها ایجاد کردند، درمان شد.
بعدها، مارشال و وارن دریافتند که آنتی بیوتیک ها در درمان ورم معده موثر هستند. در سال 1994، مؤسسه ملی بهداشت ایالات متحده گزارش داد که شایع ترین زخم معده توسط هلیکوباکتر پیلوری ایجاد می شود و استفاده از آنتی بیوتیک ها را در رژیم درمانی توصیه کرد. 7 در سال 2005، وارن و مارشال به خاطر کارشان در مورد هلیکوباکتر پیلوری جایزه نوبل پزشکی را دریافت کردند . 8
قبل از اثبات دخالت هلیکوباکتر پیلوری در بیماری های معده، زخم معده با داروهایی که اسیدیته را خنثی می کردند، درمان می شدند. این اغلب باعث می شود که زخم ها پس از قطع درمان دوباره ظاهر شوند. داروی سنتی ضد گاستریت نمک بیسموت (بیسموت ساب سیترات کلوئیدی یا بیسموت ساب سالیسیلات) بود. 9 این درمان اغلب مؤثر بود، اما اثربخشی آن با استفاده طولانی مدت کاهش یافت، علاوه بر این که مکانیسم اثر این دارو ناشناخته بود . هنوز مشخص نیست که آیا بیسموت می تواند به عنوان یک آنتی بیوتیک عمل کند یا خیر. از سال 2006، بسیاری از زخم ها به طور موثر با استفاده از آنتی بیوتیک ها علیه هلیکوباکتر پیلوری درمان می شوند .
در حالی که هلیکوباکتر پیلوری مهمترین باکتری شناخته شده ساکن معده انسان است، چند گونه دیگر از جنس هلیکوباکتر در پستانداران دیگر و برخی از پرندگان شناسایی شده است . ثابت شده است که برخی از اینها می توانند انسان را آلوده کنند. گونههایی از هلیکوباکتر وجود دارند که میتوانند کبد برخی از پستانداران را آلوده کنند، بنابراین باعث بیماریهای مختلف کبدی میشوند.
مفاهیمی بر مهاجرت های انسان ماقبل تاریخ [ ویرایش ]
هر جمعیت انسانی دارای توزیع مشخصه ای از سویه های هلیکوباکتر پیلوری است که به طور معمول اعضای جمعیت آن را آلوده می کند. این ویژگی باعث شده است تا محققان از هلیکوباکتر پیلوری برای مطالعه الگوهای مهاجرت در انسان استفاده کنند. بنابراین، انواع یافت شده به منشأ انسان های مدرن و مهاجرت های ماقبل تاریخ آنها مربوط می شود .
همانطور که گروه های انسانی منشأ آفریقا در سراسر سیاره گسترش یافتند، به تدریج از هم گسستند و ویژگی های ژنتیکی خود را متنوع کردند، جمعیت هلیکوباکتر پیلوری که با خود حمل می کردند نیز همین کار را کردند. بنابراین، سویه ای که ساکنان اروپا را آلوده می کند، به عنوان مثال، hpEurope است، در حالی که سویه های hpAsia2 و hpEastasia در جمعیت آسیایی هستند. 10 در اقیانوسیه دو نوع اصلی وجود دارد: hpSahul که بین 31000 تا 37000 سال پیش در قاره Sahul سرچشمه گرفت و نمونه ای از بومیان استرالیایی و پاپوآیی است و سویه hspMaori مربوط به سویه hpEastAsia و ظاهراً حدود 500 سال از تایوان آمده است. پیش و با مردم مالایو-پلینزی گسترش یافت . 11
توزیع فیلژوگرافی
همانطور که گفته شد هلیکوباکتر پیلوری در نیمی از جمعیت جهان وجود دارد و با شناسایی سویههای زیر میتوان آن را با مهاجرتهای انسانی و توزیع جهانی آن مرتبط کرد :
- hpAfrica1
- hspSAfrica: نمونه آفریقای جنوبی .
- hspWAfrica: در آفریقا و آمریکایی های آفریقایی تبار رایج است. نمونه غرب آفریقا .
- hpAfrica2 : در آفریقای جنوبی رایج است.
- hpNEAfrica : نمونه شاخ آفریقا و مردم نیلوصحرا . در اروپا و آسیا کم است.
- hpEurope : نمونه اوراسیا غربی ، از جمله اروپا ، خاور نزدیک ، آسیای مرکزی و بخشی از شمال آفریقا . استعمار اروپایی آن را در سراسر جهان پراکنده کرد.
- hpEastAsia
- hspEAsia: نمونه خاور دور .
- hspAmerind: نمونه مردمان بومی آمریکا .
- hspMaori: نمونه مردم مالایو-پلینزی .
- hpAsia2 : در شبه قاره هند ، بخشی از آسیای جنوب شرقی و سایر مناطق اوراسیا.
- hpSahul – در استرالیاییهای بومی و پاپوآییها .
حضور در آمریکای پیش از اسپانیایی تبار
میتوان ثابت کرد که سویههای هلیکوباکتر پیلوری در آمازونهای بومی منشأ خود را بهجای اروپا در آسیای شرقی دارند، که نشان میدهد این جمعیتها حداقل 11000 سال پیش به آمریکا رسیدهاند.
مطالعهای که توسط کارشناسان دپارتمان میکروبیولوژی و انگلشناسی دانشکده پزشکی UNAM (دانشگاه ملی خودمختار مکزیک) به رهبری گونزالو کاستیلو انجام شد و در BMC Microbiology منتشر شد و توسط INAH (موسسه ملی مردمشناسی و تاریخ) منتشر شد. ) ، وجود هلیکوباکتر پیلوری را در جوامع ماقبل اسپانیایی نشان می دهد. در طول بررسی، نمونههایی از بافت معده از 6 مومیایی (5 مورد از غار La Ventana در چیهواهوا و دیگری از دورانگو، مکزیک) استفاده شد که قدمت آن به سال 1350 باز میگردد .
ساختار باکتری
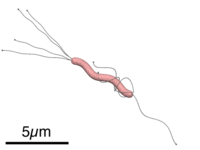
هلیکوباکتر پیلوری یک باکتری گرم منفی مارپیچی شکل یا اسپیریلوم است که 14 حدود 3 میکرومتر (میکرو متر) طول دارد و قطر تقریبی آن حدود 0.5 میکرومتر است. حدود 4-6 تاژک دارد . این میکروآئروفیل است ، یعنی به اکسیژن نیاز دارد ، اما در غلظت های پایین تر از غلظت های موجود در جو . از هیدروژن و متانوژنز به عنوان منبع انرژی استفاده می کند . همچنین اکسیداز و کاتالاز مثبت است .

این باکتری با شکل تاژک و مارپیچ خود به معنای واقعی کلمه لایه مخاطی معده را سوراخ می کند و سپس می تواند در مخاط معده معلق بماند یا به سلول های اپیتلیال بچسبد زیرا چسبنده (که پروتئین های تثبیت کننده هستند) تولید می کند. هلیکوباکتر پیلوری آنزیمی به نام اوره آز تولید می کند که از طریق واکنش، اوره را به آمونیاک و دی اکسید کربن تبدیل می کند: CO(NH 2 ) 2 + H 2 O → 2NH 3 + CO 2 ، و این آمونیاک است که تا حدی اسیدیته معده را خنثی می کند. (که برای حل کردن غذا و از بین بردن بیشتر باکتری های هضم شده عمل می کند). متأسفانه آمونیاک سمی است و به سطح سلول های اپیتلیال آسیب می رساند و باعث ایجاد زخم می شود.
عفونت هلیکوباکتر پیلوری

عفونت هلیکوباکتر پیلوری می تواند علامت دار یا بدون علامت (بدون اثرات قابل مشاهده بر روی بیمار) باشد. تخمین زده می شود که بیش از 70 درصد عفونت ها بدون علامت هستند. 15 در غیاب درمان مبتنی بر آنتی بیوتیک، عفونت هلیکوباکتر پیلوری ظاهراً در طول زندگی باقی می ماند. سیستم ایمنی انسان قادر به از بین بردن آن نیست.
مسیر عفونت
این باکتری از مدفوع ، بزاق و پلاک دندانی بیماران آلوده جدا شده است که راه دهانی – دهانی یا مدفوعی – دهانی را به عنوان راه احتمالی انتقال پیشنهاد می کند.
اپیدمیولوژی
تخمین زده می شود که بیش از دو سوم جمعیت جهان به این باکتری آلوده هستند. میزان ابتلا از کشوری به کشور دیگر متفاوت است. در جهان غرب (اروپا، آمریکا و استرالیا)، این نسبت حدود 25 درصد از جمعیت است که در جهان سوم بسیار بیشتر است . در مورد دوم، احتمالاً به دلیل شرایط بهداشتی نامناسب، یافتن عفونت در کودکان شایع است. در ایالات متحده ، عفونت عمدتاً در افراد مسن رخ می دهد (بیش از 50٪ از این موارد در افراد بالای 60 سال در مقایسه با 20٪ در افراد زیر 40 سال رخ می دهد) و در فقیرترین بخش ها.
این اختلافات به بهداشت بهتر و استفاده بیشتر از آنتی بیوتیک ها در کشورهای ثروتمندتر نسبت داده می شود. در هر صورت، در سال های اخیر سویه هایی از هلیکوباکتر پیلوری که به آنتی بیوتیک ها مقاوم هستند، ظاهر شده اند . در بریتانیا حتی سویههای مقاوم به مترونیدازول نیز وجود دارد .

1. هلیکوباکتر پیلوری به لایه مخاطی معده نفوذ کرده و به سطح لایه مخاطی اپیتلیال معده میچسبد .
2. تولید آمونیاک از اوره ، برای خنثی کردن اسید معده.
3. مهاجرت و تکثیر هلیکوباکتر پیلوری به کانون عفونت.
4. زخم معده با تخریب مخاط، التهاب و مرگ سلول های مخاطی ایجاد می شود. آمونیاک مسئول تخریب مخاط است و به اسید اجازه می دهد تا به دیواره عضلانی دستگاه گوارش نفوذ کند.
تشخیص
روش های مختلفی برای تشخیص عفونت هلیکوباکتر پیلوری وجود دارد . یکی از این روش ها تشخیص آنتی بادی های خاص در نمونه خون یا مدفوع بیمار با استفاده از آنتی ژن است . تست تنفس اوره نیز مورد استفاده قرار می گیرد که در آن بیمار اوره ای را می نوشد که با 14 یا 13 درجه سانتی گراد مشخص شده است و متعاقباً (به دلیل متابولیسم باکتری ها) دی اکسید کربن برچسب دار تولید می کند که در نفس تشخیص داده می شود. روش تشخیصی دیگر بیوپسی است که در آن اوره آز فعال در نمونه استخراج شده اندازه گیری می شود، به اصطلاح “آزمون سریع اوره آز” که شامل قرار دادن یک نمونه بافت در محیط حاوی اوره است. اگر آنزیم اوره آز تولید شده توسط باکتری وجود داشته باشد، اوره موجود در محیط را به آمونیاک و CO 2 تجزیه می کند . آمونیاک تولید شده باعث افزایش pH می شود که از طریق تغییر رنگ قابل تشخیص با چشم غیر مسلح مشهود است. راه دیگر برای تشخیص عفونت هلیکوباکتر پیلوری از طریق نمونه بافت شناسی یا کشت سلولی است . یکی از حساسترین روشهای تشخیص مربوط به PCR ( واکنش زنجیرهای پلیمراز ) است که همچنین امکان شناسایی ژنهای مرتبط با حدت (CagA و VacA)، ژنهای مرتبط با چسبندگی (BabA) و ژنهای مقاومت آنتیبیوتیکی ( کلاریترومایسین ) را فراهم میکند.
مشکلات در تشخیص
هیچ یک از این روش ها کاملاً بی خطا نیستند. برای مثال آزمایش آنتی بادی خون تنها ۷۶ تا ۸۴ درصد حساسیت دارد. از طرف دیگر دارودرمانی می تواند بر فعالیت اوره آز تأثیر بگذارد و در روش های مبتنی بر آن نتایج مثبت کاذب بدهد.
| شواهد و مدارک | مزایای | معایب | |
|---|---|---|---|
| آندوسکوپی | ∗1. بافت شناسی | حساسیت و ویژگی عالی. | گران. به لکه های خاص، زیرساخت ها و پرسنل آموزش دیده نیاز دارد. |
| ∗2. تست اوره آز سریع | ارزان و نتایج سریع ارائه می دهد. ویژگی عالی و حساسیت بسیار خوب در بیمارانی که به درستی انتخاب شده اند. | حساسیت در محیط پس از درمان به طور قابل توجهی کاهش یافت. | |
| ∗3. برش | ویژگی عالی امکان تعیین حساسیت آنتی بیوتیکی را فراهم می کند. | گران است، ساخت آن دشوار است، زیرا به بافت نیاز دارد و در یک محیط میکروآئروفیل رشد می کند و به طور گسترده در دسترس نیست. فقط حساسیت حاشیه ای. | |
| ∗4. واکنش زنجیره ای پلیمراز (PCR) | حساسیت و ویژگی عالی. امکان تعیین حساسیت آنتی بیوتیکی را فراهم می کند. | روش شناسی در آزمایشگاه ها استاندارد نشده و به طور گسترده در دسترس نیست. | |
| غیر آندوسکوپی | 1. آزمایش آنتی بادی (کمی و کیفی) | آنها آنتیبادیها را اندازهگیری میکنند نه آنتیژن، بنابراین تماس، بیماری فعلی، VNA ارزان، در دسترس، بسیار خوب را گزارش میدهند. | شیوع پس زمینه وابسته به PPV هلیکوباکتر پیلوری . پس از درمان هلیکوباکتر پیلوری توصیه نمی شود . |
| ∗2. تست تنفس اوره (13 و 14 درجه سانتیگراد) | عفونت فعال هلیکوباکتر پیلوری را با نتایج کمی شناسایی می کند. PPV و VNA عالی بدون توجه به شیوع هلیکوباکتر پیلوری . قبل و بعد از درمان هلیکوباکتر پیلوری ، با شرایط خاص بیمار برای جلوگیری از منفی کاذب مفید است. | ||
| ∗3. آزمایش آنتی ژن مدفوع | عفونت فعال هلیکوباکتر پیلوری را شناسایی کنید . ارزش اخباری مثبت و منفی عالی بدون توجه به شیوع هلیکوباکتر پیلوری . قبل و بعد از درمان هلیکوباکتر پیلوری مفید است | تست مونوکلونال قبل و بعد از درمان آنتی بیوتیکی قابل اعتماد به نظر می رسد. |
حساسیت تستهای آندوسکوپی و غیر آندوسکوپی که عفونت فعال هلیکوباکتر پیلوری را شناسایی میکنند با استفاده اخیر از PPI، بیسموت یا آنتیبیوتیکها کاهش مییابد. PPI = بازدارنده پمپ پروتون. PPV = ارزش اخباری مثبت. NPV = ارزش اخباری منفی. UBT = تست تنفس اوره.
پیشگیری
مطالعهای که در سال 2008 در مجله کرهای میکروبیولوژی و بیوتکنولوژی منتشر شد ، نشان داد که کیمچی (غذاهای سنتی کرهای که از سبزیجات تخمیر شده تهیه میشود) حاوی سویهای از نوعی باکتری است که فعالیت آنتاگونیستی قوی علیه هلیکوباکتر پیلوری نشان میدهد . نشان داده شد که انواع جدا شده از باکتری کیمچی به نام Lb. پلانتاروم NO1 ، فعالیت اوره آز هلیکوباکتر پیلوری را 40 تا 60 درصد کاهش می دهد و رشد سلول های سرطانی را تا بیش از 33 درصد لغو می کند. 16 مطالعه ای در سال 2009 نشان داد که چای سبز می تواند از التهاب ناشی از هلیکوباکتر پیلوری جلوگیری کند . 17 18
درمان [ ویرایش ]

در ابتدا از مترونیدازول استفاده شد که در حال حاضر در بیش از 80 درصد موارد مقاومت نشان می دهد. [ نیاز به ذکر منبع ] متعاقباً، تنها زمانی که عفونت علامتی رخ داد، درمان شد، در این مورد از کلاریترومایسین ، آموکسی سیلین و تتراسایکلین استفاده شد . در حال حاضر، درمان سه گانه متشکل از یک مهارکننده پمپ پروتون (PPI) ( امپرازول ، لانسوپرازول ، پانتوپرازول ، رابپرازول و غیره)، به علاوه دو آنتی بیوتیک: آموکسی سیلین و کلاریترومایسین ، درمان انتخابی زمانی است که مقاومت به کلاریترومایسین توسط هلیکوباکتر از 20% بیشتر نباشد. . در صورت حساسیت به پنی سیلین، آموکسی سیلین را می توان با مترونیدازول جایگزین کرد . ریشه کنی در 80-84 درصد موارد حاصل می شود. 19
هنگامی که هلیکوباکتر پیلوری در بیماران مبتلا به زخم معده تشخیص داده شد، روش طبیعی این است که آن را ریشه کن کرده و اجازه دهید زخم بهبود یابد. درمان خط اول سنتی یک هفته درمان سه گانه متشکل از آنتی بیوتیک های آموکسی سیلین و کلاریترومایسین و یک مهارکننده پمپ پروتون مانند امپرازول است . 20 توماس بورودی متخصص گوارش از سیدنی، استرالیا، اولین درمان سه گانه را در سال 1987 اختراع کرد. 21 در طول سال ها، انواع درمان های سه گانه، مانند استفاده از مهارکننده های پمپ پروتون مختلف، مانند پانتوپرازول یا رابپرازول ، یا تغییر آموکسی سیلین به مترونیدازول برای افرادی که به پنی سیلین حساسیت دارند . 22 چنین درمان هایی انقلابی در درمان زخم گوارشی ایجاد کرده و درمان این بیماری را ممکن ساخته است.
مشخص شده است که افراد آلوده بیشتر و بیشتر دارای باکتری های مقاوم به آنتی بیوتیک هستند، بنابراین درمان اولیه بی اثر است و دورهای بیشتری از درمان های آنتی بیوتیکی یا استراتژی های جایگزین مانند درمان چهارگانه مورد نیاز است. ترکیبات بیسموت نیز در ترکیب با درمان سنتی موثر است. برای درمان سویه های هلیکوباکتر پیلوری مقاوم به کلاریترومایسین، لووفلوکساسین به عنوان بخشی از درمان استفاده می شود. [ نیازمند منبع ]
اعتقاد بر این است که، در غیاب درمان، هنگامی که عفونت هلیکوباکتر پیلوری در حفره معده خود مستقر شد، تا آخر عمر باقی خواهد ماند. با این حال ، در افراد مسن ممکن است عفونت ناپدید شود زیرا مخاط معده به طور فزایندهای آتروفیک میشود و برای کلونیزاسیون غیرمیزان میشود. نسبت عفونتهای حاد که ادامه مییابند مشخص نیست، اما چندین مطالعه به دنبال تاریخ طبیعی در جمعیتهای مختلف، پاکسازی ظاهری خود به خود را گزارش کردهاند. 25 26

دانشمندان دانشگاه کیوتو ژاپن تأیید کردند که اسانس Cymbopogon citratus رشد باکتری هلیکوباکتر پیلوری را در محیط کشت مهار می کند، بدون اینکه باکتری ها در برابر درمان با این اسانس مقاومت نشان دهند. 27 هیچ مدرکی مبنی بر موثر بودن این روغن یا سایر اسانس ها در درمان عفونت معده در انسان وجود ندارد.
مطالعه دیگری از دانشگاه پزشکی Dankook در Cheonan، کره جنوبی، استفاده از آدامس را به کاهش قابل توجه حضور هلیکوباکتر پیلوری در روده و کاهش التهاب در آن مرتبط میداند. 28 از این نظر جویدن این آدامس یکی از ابتکاری ترین و کم تهاجمی ترین درمان ها برای هلیکوباکتر پیلوری محسوب می شود. 29
عفونت بدون علامت
در بیماران مبتلا به عفونت بدون علامت، درمان به طور کلی توصیه نمی شود. تظاهرات علامتی خاص هر بیمار باید مورد توجه قرار گیرد.
عفونت علامت دار
در بیماران مبتلا به زخم معده که در آن هلیکوباکتر پیلوری تشخیص داده می شود ، روش معمول ریشه کن کردن آن تا بهبودی زخم است. گسترده ترین درمان سه گانه درمانی است . توماس بورودی ، متخصص گوارش سیدنی ، اولین درمان سه گانه را در سال 1987 اختراع کرد. امروزه، درمان سه گانه استاندارد آموکسی سیلین ، کلاریترومایسین و امپرازول است . در برخی موارد، از یک بازدارنده پمپ پروتون متفاوت استفاده می شود . در بیمارانی که به پنی سیلین حساسیت دارند از مترونیدازول به جای آموکسی سیلین استفاده می شود . این درمان انقلابی در درمان زخم معده ایجاد کرده و درمان این بیماری را ممکن ساخته است، در حالی که قبلا فقط علائم با استفاده از آنتی اسیدها ، آنتاگونیست های گیرنده H2 یا مهارکننده های پمپ پروتون کنترل می شد .
متأسفانه، تعداد عفونت های فردی حامل سویه های مقاوم به این اولین درمان آنتی بیوتیکی افزایش یافته است. این باعث شده است که درمان اولیه با شکست مواجه شود و نیاز به استفاده از آنتی بیوتیک درمانی بیشتری داشته باشد. سپس از یک درمان چهارگانه استفاده می شود که شامل بیسموت است ، فلزی که در ترکیب با سایر داروها نیز موثر است.
در موارد مقاومت به کلاریترومایسین ، استفاده از لووفلوکساسین به عنوان بخشی از درمان توصیه می شود.
سرطان و هلیکوباکتر پیلوری
سرطان معده و لنفوم MALT (لنفوم بافت لنفاوی مرتبط با مخاط) با هلیکوباکتر پیلوری مرتبط است ، به همین دلیل این باکتری توسط آژانس بین المللی تحقیقات سرطان به عنوان سرطان زا گروه I طبقه بندی شده است . در حالی که ارتباط این بیماری ها با هلیکوباکتر پیلوری با سوء ظن منطقی پشتیبانی می شود، کاملاً مشخص نیست که یک رابطه علّی در آن دخیل است.
مکانیسم های عمل
دو مکانیسم مربوط به این توانایی فرضی هلیکوباکتر پیلوری در ایجاد سرطان در حال بررسی است . اولین مورد شامل امکان تولید رادیکال های آزاد مرتبط با عفونت هلیکوباکتر پیلوری است که باعث افزایش سرعت جهش سلول میزبان می شود . مکانیسم دوم مسیر پری ژنتیک 30 نامیده می شود و شامل تبدیل فنوتیپ سلول میزبان از طریق تغییرات در پروتئین های سلولی مانند پروتئین های چسبنده است . این احتمال وجود دارد که هلیکوباکتر پیلوری باعث التهاب و سطوح بالای موضعی TNF-آلفا یا اینترلوکین 6 شود . با توجه به مکانیسم پری ژنتیک پیشنهادی، مولکول های سیگنال دهنده التهاب مانند TNF-alpha می توانند ظرفیت چسبندگی سلول های اپیتلیال معده را تغییر داده و منجر به پراکندگی و مهاجرت این سلول های اپیتلیال جهش یافته، بدون نیاز به تغییرات اضافی در ژن های سرکوبگر تومور شوند. (مانند، برای مثال، ژن هایی که پروتئین های چسبندگی سلولی را رمزگذاری می کنند ).
رفلاکس اسید و سرطان مری
میزان عفونت هلیکوباکتر پیلوری در کشورهای توسعه یافته به دلیل بهبود بهداشت و افزایش استفاده از آنتی بیوتیک ها رو به کاهش بوده است . در نتیجه، بروز سرطان معده در ایالات متحده طی دوره بین سالهای 1900 تا 2000 80 درصد کاهش یافته است. با این حال، در همین دوره، بیماریهای خاص مرتبط با ریفلاکس معده و سرطان مری افزایش چشمگیری داشته است .
مطالعات ژنومی سویه های مختلف

چندین سویه هلیکوباکتر شناخته شده است که ژنوم دو تای آنها به طور کامل توالی یابی شده است. 31
ژنوم سویه “26695” از 1.7 میلیون جفت باز نیتروژن تشکیل شده است که در مجموع تقریباً 1550 ژن دارد . دو سویه توالییابی شده تفاوتهای ژنتیکی زیادی را نشان میدهند، با بیش از 6 درصد نوکلئوتیدهای متفاوت .
مطالعه ژنوم هلیکوباکتر پیلوری بر جنبه های مرتبط با بیماری زایی ، یعنی توانایی این ارگانیسم در ایجاد بیماری تمرکز دارد. در پایگاه داده ژنوم هلیکوباکتر پیلوری حدود 62 ژن در دسته پاتوژنز وجود دارد .
جزیره کگ بیماری زایی
هر دو سویه توالی یابی شده دارای جزیره بیماریزایی هستند (توالی ژن هایی که اعتقاد بر این است که در ظرفیت عفونی باکتری دخیل هستند) به نام Cag : اندازه آن 40 کیلو باز است و شامل حدود 40 ژن است . این جزیره بیماریزایی به طور کلی در سویه های هلیکوباکتر پیلوری جدا شده از انسان با عفونت های بدون علامت وجود ندارد .
ژن cagA یکی از اصلی ترین پروتئین های حدت در هلیکوباکتر پیلوری را کد می کند . سویه های باکتریایی که دارای ژن cagA هستند با توانایی ایجاد زخم های شدید مرتبط هستند. این ژن برای سنتز یک پروتئین نسبتا طولانی (1186 اسید آمینه ) کد می کند. پروتئین CagA وارد سلول های انسانی می شود و در آنجا عملکرد طبیعی اسکلت سلولی را مختل می کند . جزیره بیماریزایی Cag حدود 30 ژن دارد که یک مجموعه انتقال ( سیستم ترشح نوع IV ) را رمزگذاری می کنند. پس از اتصال به سلول های اپیتلیال معده، پروتئین CagA از طریق این سیستم ترشحی به سلول تزریق می شود . پروتئین CagA بر روی یک باقیمانده تیروزین خاص توسط پروتئین های غشای سلول میزبان فسفریله می شود . نشان داده شده است که سویه های بیماریزای هلیکوباکتر پیلوری گیرنده فاکتور رشد اپیدرمی ( EGFR ) را فعال می کنند که یک پروتئین غشایی با تیروزین کیناز است . فعال سازی EGFR توسط هلیکوباکتر پیلوری با تغییرات در انتقال ژن و سیگنال های بیان در سلول های میزبان همراه است و این واقعیت ممکن است به بیماری زایی آن کمک کند. همچنین پیشنهاد شده است که ناحیه C ترمینال پروتئین CagA (اسیدهای آمینه 1002-873) می تواند رونویسی ژن سلول میزبان را مستقل از فسفوریلاسیون تنظیم کند . تصور می شود که به دلیل محتوای GC پایین ژن cagA نسبت به بقیه ژنوم، این ژن با انتقال افقی از یک باکتری دیگر cagA + به دست آمده است .
