اپیدمیولوژی مطالعه و تجزیه و تحلیل توزیع (چه کسی، چه زمانی و کجا)، الگوها و عوامل تعیین کننده وضعیت سلامت و بیماری در یک جمعیت تعریف شده است .
این سنگ بنای سلامت عمومی است و با شناسایی عوامل خطر بیماری و اهداف مراقبت های بهداشتی پیشگیرانه ، تصمیمات خط مشی و اقدامات مبتنی بر شواهد را شکل می دهد . اپیدمیولوژیست ها در طراحی مطالعه، جمع آوری و تجزیه و تحلیل آماری داده ها، اصلاح تفسیر و انتشار نتایج (از جمله بررسی همتا و مرور سیستماتیک گاه به گاه ) کمک می کنند. اپیدمیولوژی به توسعه روش شناسی مورد استفاده در تحقیقات بالینی ، مطالعات بهداشت عمومی ، و تا حدی کمتر، تحقیقات پایه در علوم زیستی کمک کرده است. [1]
زمینه های عمده مطالعات اپیدمیولوژیک شامل علت بیماری، انتقال ، بررسی شیوع بیماری، نظارت بر بیماری ، اپیدمیولوژی محیطی ، اپیدمیولوژی پزشکی قانونی ، اپیدمیولوژی شغلی ، غربالگری ، نظارت زیستی و مقایسه اثرات درمان مانند آزمایشات بالینی است . اپیدمیولوژیست ها برای درک بهتر فرآیندهای بیماری، آمار برای استفاده موثر از داده ها و نتیجه گیری مناسب، علوم اجتماعی برای درک بهتر علل نزدیک و دور، و مهندسی برای ارزیابی مواجهه ، به سایر رشته های علمی مانند زیست شناسی تکیه می کنند .
اپیدمیولوژی ، که به معنای واقعی کلمه به معنای «مطالعه آنچه بر مردم است»، از یونانی epi «در میان»، demos «مردم، ناحیه» و logos «مطالعه، کلمه، گفتمان» مشتق شده است، که نشان میدهد فقط در مورد انسان صدق میکند. جمعیت ها با این حال، این اصطلاح به طور گسترده در مطالعات جمعیت های جانورشناسی (اپیدمیولوژی دامپزشکی) استفاده می شود، اگرچه اصطلاح ” اپیزولوژی ” موجود است، و همچنین برای مطالعات جمعیت های گیاهی (گیاه شناسی یا اپیدمیولوژی بیماری های گیاهی ) به کار رفته است . [2]
تمایز بین «همهگیری» و «بومی» برای اولین بار توسط بقراط [ 3] برای تمایز بین بیماریهایی که در یک جمعیت «بازدید میشوند» (اپیدمی) از بیماریهایی که «در درون» یک جمعیت ساکن هستند (بومی) ترسیم شد. [4] به نظر می رسد که اصطلاح “اپیدمیولوژی” برای اولین بار برای توصیف مطالعه اپیدمی ها در سال 1802 توسط پزشک اسپانیایی خواکین د ویلالبا در Epidemiología Española استفاده شده است . [4] اپیدمیولوژیست ها همچنین تعامل بیماری ها را در یک جمعیت مطالعه می کنند، وضعیتی که به عنوان سندرم شناخته می شود .
اصطلاح اپیدمیولوژی در حال حاضر به طور گسترده برای پوشش دادن توصیف و علت نه تنها بیماری همه گیر، عفونی، بلکه بیماری به طور کلی، از جمله شرایط مرتبط به کار می رود. برخی از نمونههایی از موضوعاتی که از طریق اپیدمیولوژی بررسی میشوند عبارتند از فشار خون بالا، بیماری روانی و چاقی . بنابراین، این اپیدمیولوژی مبتنی بر این است که چگونه الگوی بیماری باعث تغییر در عملکرد انسان می شود.
تاریخچه [ ویرایش ]
بقراط ، پزشک یونانی ، که توسط دموکریتوس تدریس می شد، به عنوان پدر پزشکی شناخته می شد . [5] [6] به دنبال منطقی برای بیماری بود. او اولین کسی است که روابط بین وقوع بیماری و تأثیرات محیطی را بررسی کرده است. [7] بقراط معتقد بود که بیماری بدن انسان ناشی از عدم تعادل چهار حالت (صفرای سیاه، صفرای زرد، خون و بلغم) است. درمان بیماری حذف یا اضافه کردن شوخ طبعی مورد بحث برای تعادل بدن بود. این عقیده باعث کاربرد خون ریزی و رژیم گرفتن در پزشکی شد. [8] او اصطلاحات آندمیک (برای بیماری هایی که معمولاً در بعضی جاها یافت می شوند اما در بعضی جاها نه) و اپیدمی (برای بیماری هایی که در بعضی مواقع دیده می شوند اما در بعضی مواقع دیده نمی شوند) را ابداع کرد. [9]
دوران مدرن [ ویرایش ]
در اواسط قرن شانزدهم، دکتری از ورونا به نام گیرولامو فراکاستورو اولین کسی بود که نظریهای را ارائه کرد مبنی بر اینکه ذرات بسیار کوچک و غیرقابل مشاهده که باعث بیماری میشوند زنده هستند. آنها را می توان از طریق هوا پخش کرد، خود را تکثیر کرد و با آتش از بین رفت. به این ترتیب او نظریه میاسما (گاز سمی در افراد بیمار) جالینوس را رد کرد. در سال 1543 او کتاب De contagione et contagiosis morbis را نوشت که در آن اولین کسی بود که بهداشت فردی و محیطی را برای جلوگیری از بیماری ترویج کرد. توسعه یک میکروسکوپ به اندازه کافی قدرتمند توسط Antonie van Leeuwenhoek در سال 1675 شواهد بصری از ذرات زنده را ارائه داد که با نظریه میکروب بیماری سازگار است . [ نیازمند منبع ]
در طول سلسله مینگ ، وو یوکه (1582-1652) این ایده را توسعه داد که برخی از بیماری ها توسط عوامل قابل انتقال ایجاد می شوند، که او آن را لی چی (戾气 یا عوامل آفت زا) نامید، زمانی که بین سال های 1641 تا 1644 همه گیری های مختلف را در اطراف خود مشاهده کرد . 10] کتاب وی ون یی لون (瘟疫论، رساله در مورد آفت / رساله بیماری های همه گیر) را می توان به عنوان اصلی ترین اثر علت شناختی که این مفهوم را مطرح کرد در نظر گرفت. [11] مفاهیم او هنوز در تحلیل شیوع سارس توسط WHO در سال 2004 در زمینه طب سنتی چینی مورد توجه قرار می گرفت. [12]
یکی دیگر از پیشگامان، توماس سیدنهام (1624-1689)، اولین کسی بود که تب لندنی ها را در اواخر دهه 1600 تشخیص داد. نظریه های او در مورد درمان تب با مقاومت زیادی از سوی پزشکان سنتی در آن زمان مواجه شد. او نتوانست علت اولیه تب آبله را که در مورد آن تحقیق و درمان کرد، بیابد. [8]
جان گرانت ، مغازهدار و آماردان آماتور، مشاهدات طبیعی و سیاسی را بر روی لوایح مرگومیر در سال 1662 منتشر کرد. در آن، او فهرست مرگومیر در لندن را قبل از طاعون بزرگ تجزیه و تحلیل کرد ، یکی از اولین جداول زندگی را ارائه کرد و گزارش داد. روند زمان برای بسیاری از بیماری ها، جدید و قدیمی. او شواهدی آماری برای بسیاری از نظریه ها در مورد بیماری ارائه کرد و همچنین برخی از ایده های رایج در مورد آنها را رد کرد. [ نیازمند منبع ]
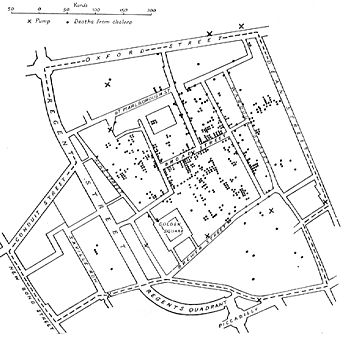
جان اسنو به دلیل تحقیقات خود در مورد علل اپیدمی وبا در قرن نوزدهم مشهور است و همچنین به عنوان پدر اپیدمیولوژی (مدرن) شناخته می شود. [13] [14] او با توجه به نرخ مرگ و میر به طور قابل توجهی بالاتر در دو منطقه ارائه شده توسط شرکت Southwark شروع کرد. شناسایی پمپ استریت براد به عنوان عامل اپیدمی سوهو، نمونه کلاسیک اپیدمیولوژی محسوب می شود. برف در تلاشی برای تمیز کردن آب از کلر استفاده کرد و دسته را جدا کرد. این به شیوع پایان داد. این به عنوان یک رویداد مهم در تاریخ بهداشت عمومی تلقی شده است و به عنوان رویداد پایه گذاری علم اپیدمیولوژی در نظر گرفته شده است که به شکل گیری سیاست های بهداشت عمومی در سراسر جهان کمک کرده است. [15] [16] با این حال، تحقیقات و اقدامات پیشگیرانه اسنو برای جلوگیری از شیوع بیشتر به طور کامل پذیرفته نشد یا تا پس از مرگ او عملی نشد و دلیل آن نظریه غالب میاسما در آن زمان بود، مدلی از بیماری که در آن کیفیت پایین هوا مقصر بود. برای بیماری این به جای پرداختن به مسائل اساسی تغذیه و بهداشت نامناسب برای منطقی کردن نرخ بالای عفونت در مناطق فقیر استفاده شد و با کار او نادرست بودن آن ثابت شد. [17]
پیشگامان دیگر عبارتند از پزشک دانمارکی پیتر آنتون شلیزنر ، که در سال 1849 کار خود را در مورد پیشگیری از همه گیری کزاز نوزادان در جزایر وستمانا در ایسلند بیان کرد . [18] [19] یکی دیگر از پیشگامان مهم، پزشک مجارستانی ایگناز سملوایس بود که در سال 1847 مرگ و میر نوزادان را در بیمارستانی در وین با ایجاد یک روش ضد عفونی کاهش داد. یافتههای او در سال 1850 منتشر شد، اما همکارانش از کارش استقبال نکردند و این روش را متوقف کردند. تا زمانی که جراح بریتانیایی جوزف لیستر در سال 1865 در پرتو کار لویی پاستور ، ضدعفونیکنندهها را کشف کرد، گندزدایی به طور گسترده انجام نشد . [ نیازمند منبع ]
در اوایل قرن بیستم، روشهای ریاضی توسط رونالد راس ، جانت لین-کلیپون ، اندرسون گری مککندریک و دیگران وارد اپیدمیولوژی شدند . [20] [21] [22] [23] در یک تحول موازی در طول دهه 1920، ماکس آسکانازی آسیب شناس آلمانی-سوئیسی و دیگران انجمن بین المللی آسیب شناسی جغرافیایی را برای بررسی سیستماتیک آسیب شناسی جغرافیایی سرطان و سایر بیماری های غیر عفونی در سراسر جهان تأسیس کردند. جمعیت در مناطق مختلف پس از جنگ جهانی دوم، ریچارد دال و سایر غیرآسیب شناسان به این رشته و روش های پیشرفته برای مطالعه سرطان پیوستند، بیماری با الگوها و نحوه وقوع که با روش های توسعه یافته برای اپیدمی بیماری های عفونی قابل مطالعه نبود. آسیب شناسی جغرافیا در نهایت با اپیدمیولوژی بیماری های عفونی ترکیب شد و زمینه ای را ایجاد کرد که امروزه اپیدمیولوژی است. [24]
پیشرفت دیگری در سال 1954 انتشار نتایج یک مطالعه پزشکان بریتانیایی به رهبری ریچارد دال و آستین برادفورد هیل بود که از ارتباط بین سیگار کشیدن و سرطان ریه پشتیبانی آماری بسیار قوی داشت . [ نیازمند منبع ]
در اواخر قرن بیستم، با پیشرفت علوم زیست پزشکی، تعدادی از نشانگرهای مولکولی در خون، سایر نمونههای زیستی و محیط به عنوان پیشبینیکنندههای توسعه یا خطر یک بیماری خاص شناسایی شدند. تحقیقات اپیدمیولوژی برای بررسی رابطه بین این بیومارکرهای تجزیه و تحلیل شده در سطح مولکولی و بیماری به طور گسترده ” اپیدمیولوژی مولکولی ” نامیده شد. به طور خاص، ” اپیدمیولوژی ژنتیکی ” برای اپیدمیولوژی تنوع ژنتیکی و بیماری ژرمین استفاده شده است. تنوع ژنتیکی معمولاً با استفاده از DNA از لکوسیتهای خون محیطی تعیین میشود. [ نیازمند منبع ]
قرن 21 [ ویرایش ]
از دهه 2000، مطالعات انجمن گسترده ژنوم (GWAS) معمولاً برای شناسایی عوامل خطر ژنتیکی برای بسیاری از بیماری ها و شرایط بهداشتی انجام شده است. [ نیازمند منبع ]
در حالی که بیشتر مطالعات اپیدمیولوژی مولکولی هنوز از سیستمهای تشخیص و طبقهبندی بیماریهای مرسوم استفاده میکنند، به طور فزایندهای تشخیص داده میشود که پیشرفت بیماری نشاندهنده فرآیندهای ذاتاً ناهمگن است که از فردی به فرد دیگر متفاوت است. از نظر مفهومی، هر فرد دارای یک فرآیند بیماری منحصر به فرد متفاوت از هر فرد دیگری است (“اصل بیماری منحصر به فرد”)، [25] [26] با در نظر گرفتن منحصر به فرد بودن اکسپوزوم (کلی از مواجهه های درون زا و برون زا / محیطی) و تأثیر منحصر به فرد آن بر فرآیند پاتولوژیک مولکولی در هر فرد مطالعات برای بررسی رابطه بین قرار گرفتن در معرض و نشانه پاتولوژیک مولکولی بیماری (به ویژه سرطان ) در طول دهه 2000 به طور فزاینده ای رایج شد. با این حال، استفاده از آسیب شناسی مولکولی در اپیدمیولوژی چالش های منحصر به فردی از جمله فقدان دستورالعمل های تحقیقاتی و روش های آماری استاندارد شده ، و کمبود کارشناسان بین رشته ای و برنامه های آموزشی را به همراه داشت. [27] علاوه بر این، به نظر میرسد که مفهوم ناهمگونی بیماری با این فرض قدیمی در اپیدمیولوژی که افراد با نام بیماری یکسان علل و فرآیندهای بیماری مشابهی دارند در تضاد باشد. برای حل این مسائل و پیشرفت علم سلامت جمعیت در عصر پزشکی دقیق مولکولی ، “آسیب شناسی مولکولی” و “اپیدمیولوژی” ادغام شد تا زمینه بین رشته ای جدیدی از ” اپیدمیولوژی پاتولوژیک مولکولی ” (MPE)، [28] [29] تعریف شود . به عنوان “اپیدمیولوژی آسیب شناسی مولکولی و ناهمگنی بیماری”. در MPE، محققین روابط بین (A) عوامل محیطی، رژیم غذایی، سبک زندگی و ژنتیکی را تجزیه و تحلیل می کنند. (ب) تغییرات در مولکول های سلولی یا خارج سلولی. و (ج) تکامل و پیشرفت بیماری. درک بهتر ناهمگونی پاتوژنز بیماری بیشتر به روشن شدن علل بیماری کمک می کند. رویکرد MPE را می توان نه تنها برای بیماری های نئوپلاستیک بلکه برای بیماری های غیر نئوپلاستیک نیز اعمال کرد. [30] مفهوم و پارادایم MPE در دهه 2010 گسترده شده است. [31] [32] [33] [34] [35] [36] [37] [ استنادهای بیش از حد ]
تا سال 2012، مشخص شد که تکامل بسیاری از پاتوژنها به اندازهای سریع است که با اپیدمیولوژی مرتبط باشد، و بنابراین میتوان از یک رویکرد بین رشتهای به بیماریهای عفونی با ادغام اپیدمیولوژی و تکامل مولکولی برای اطلاع از استراتژیهای کنترل یا حتی درمان بیمار، چیزهای زیادی به دست آورد. ” [38] [39] مطالعات اپیدمیولوژیک مدرن می تواند از آمارهای پیشرفته و یادگیری ماشینی برای ایجاد مدل های پیش بینی و همچنین برای تعریف اثرات درمانی استفاده کند. [40] [41] به رسمیت شناخته شده است که طیف گسترده ای از منابع داده مدرن، که بسیاری از آنها از مراقبت های بهداشتی یا اپیدمیولوژی نشات نمی گیرند، می توانند برای مطالعات اپیدمیولوژیک استفاده شوند. [42] چنین اپیدمیولوژی دیجیتالی می تواند شامل داده های جستجوی اینترنتی، سوابق تلفن همراه و خرده فروشی داروها باشد. [ نیازمند منبع ]
انواع مطالعات [ ویرایش ]
اپیدمیولوژیستها طیف وسیعی از طرحهای مطالعه را از مشاهدهای تا تجربی و عموماً بهعنوان توصیفی (شامل ارزیابی دادههای مربوط به زمان، مکان و شخص)، تحلیلی (با هدف بررسی بیشتر ارتباطهای شناخته شده یا روابط فرضی) و تجربی (یک اصطلاح) طبقهبندی میکنند. اغلب با کارآزماییهای بالینی یا اجتماعی درمانها و سایر مداخلات برابر است). در مطالعات مشاهدهای، همانطور که اپیدمیولوژیستها از حاشیه مشاهده میکنند، به طبیعت اجازه داده میشود تا “مسیر خود را طی کند”. برعکس، در مطالعات تجربی، اپیدمیولوژیست کسی است که همه عوامل ورود به یک مطالعه موردی خاص را کنترل می کند. [43] هدف مطالعات اپیدمیولوژیک، در صورت امکان، آشکار کردن روابط بیطرفانه بین مواجهههایی مانند الکل یا سیگار، عوامل بیولوژیکی ، استرس ، یا مواد شیمیایی با مرگ و میر یا عوارض است . شناسایی روابط علی بین این مواجهه ها و پیامدها جنبه مهمی از اپیدمیولوژی است. اپیدمیولوژیست های مدرن از انفورماتیک به عنوان ابزار استفاده می کنند. [ نیازمند منبع ]
مطالعات مشاهده ای دارای دو مولفه توصیفی و تحلیلی است. مشاهدات توصیفی مربوط به “چه کسی، چه، کجا و چه زمانی وقوع وضعیت مرتبط با سلامتی” است. با این حال، مشاهدات تحلیلی بیشتر با “چگونگی” یک رویداد مرتبط با سلامت سروکار دارند. [43] اپیدمیولوژی تجربی شامل سه نوع مورد است: کارآزماییهای تصادفیسازی و کنترلشده (اغلب برای یک دارو یا آزمایش دارویی جدید استفاده میشود)، کارآزمایی میدانی (بر روی افرادی که در معرض خطر بالای ابتلا به بیماری هستند) و کارآزماییهای اجتماعی (تحقیق در مورد بیماریهای منشأ اجتماعی). ). [43]
اصطلاح “سه گانه اپیدمیولوژیک” برای توصیف تقاطع میزبان ، عامل و محیط در تجزیه و تحلیل یک شیوع استفاده می شود. [ نیازمند منبع ]
سری پرونده [ ویرایش ]
مجموعه موردی ممکن است به مطالعه کیفی تجربه یک بیمار منفرد، یا گروه کوچکی از بیماران با تشخیص مشابه، یا به یک عامل آماری با پتانسیل ایجاد بیماری با دورههایی اشاره داشته باشد که در معرض آنها قرار نگرفتهاند. [44]
نوع اول مطالعه صرفاً توصیفی است و نمی توان از آن برای استنباط در مورد جمعیت عمومی بیماران مبتلا به آن بیماری استفاده کرد. این نوع از مطالعات، که در آن یک پزشک زیرک یک ویژگی غیرمعمول یک بیماری یا سابقه بیمار را شناسایی می کند، ممکن است منجر به فرمول بندی یک فرضیه جدید شود. با استفاده از داده های این سری، می توان مطالعات تحلیلی را برای بررسی عوامل علّی احتمالی انجام داد. اینها می تواند شامل مطالعات مورد شاهدی یا مطالعات آینده نگر باشد. یک مطالعه مورد-شاهدی شامل تطبیق کنترل های قابل مقایسه بدون بیماری با موارد موجود در این سری است. یک مطالعه آینده نگر شامل دنبال کردن سری موارد در طول زمان برای ارزیابی تاریخچه طبیعی بیماری است. [45]
نوع دوم، که به طور رسمی تر به عنوان مطالعات سری موردی خودکنترل توصیف می شود، زمان پیگیری فردی بیمار را به دوره های در معرض و بدون مواجهه تقسیم می کند و از فرآیندهای رگرسیون پواسون با اثرات ثابت برای مقایسه میزان بروز یک پیامد معین بین دوره های مواجهه و بدون مواجهه استفاده می کند. . این تکنیک به طور گسترده در مطالعه واکنش های نامطلوب به واکسیناسیون استفاده شده است و در برخی شرایط نشان داده شده است که قدرت آماری قابل مقایسه با آنچه در مطالعات کوهورت موجود است ارائه می دهد. [ نیازمند منبع ]
مطالعات مورد شاهدی [ ویرایش ]
مطالعات مورد-شاهدی افراد را بر اساس وضعیت بیماری آنها انتخاب می کنند. این یک مطالعه گذشته نگر است. گروهی از افراد مثبت به بیماری (گروه “مورد”) با گروهی از افراد منفی بیماری (گروه “کنترل”) مقایسه می شوند. گروه کنترل در حالت ایده آل باید از همان جمعیتی باشد که منجر به این موارد شده است. مطالعه مورد-شاهدی در طول زمان به مواجهه های بالقوه ای می پردازد که هر دو گروه (مورد و شاهد) ممکن است با آن مواجه شده باشند. یک جدول 2×2 ساخته شده است که موارد در معرض (A)، کنترل های در معرض (B)، موارد در معرض نور (C) و کنترل های بدون نور (D) را نشان می دهد. آماری که برای اندازهگیری ارتباط ایجاد میشود، نسبت شانس (OR) است، که نسبت شانس مواجهه در موارد (A/C) به شانس قرار گرفتن در معرض در کنترلها (B/D)، یعنی OR = (AD) است. /قبل از میلاد مسیح). [ نیازمند منبع ]
| موارد | کنترل ها | |
|---|---|---|
| در معرض دید | آ | ب |
| در معرض قرار نگرفته است | سی | D |
اگر OR به طور قابل توجهی بزرگتر از 1 باشد، نتیجه این است که “کسانی که به این بیماری مبتلا شده اند به احتمال زیاد در معرض قرار گرفته اند”، در حالی که اگر نزدیک به 1 باشد، قرار گرفتن در معرض و بیماری احتمالاً مرتبط نیستند. اگر OR بسیار کمتر از یک باشد، این نشان می دهد که قرار گرفتن در معرض یک عامل محافظتی در ایجاد بیماری است. مطالعات مورد-شاهدی معمولاً سریعتر و مقرون به صرفه تر از مطالعات کوهورت هستند ، اما به سوگیری حساس هستند (مانند سوگیری یادآوری و سوگیری انتخاب ). چالش اصلی شناسایی گروه کنترل مناسب است. توزیع قرار گرفتن در معرض در بین گروه کنترل باید نماینده توزیع در جمعیتی باشد که منجر به این موارد شده است. این را می توان با کشیدن یک نمونه تصادفی از جمعیت اصلی در معرض خطر به دست آورد. این در نتیجه این است که گروه کنترل می تواند شامل افراد مبتلا به بیماری تحت مطالعه باشد، زمانی که بیماری دارای نرخ حمله بالایی در یک جمعیت باشد. [ نیازمند منبع ]
یک اشکال عمده برای مطالعات مورد شاهدی این است که، برای اینکه از نظر آماری معنی دار در نظر گرفته شود، حداقل تعداد موارد مورد نیاز در فاصله اطمینان 95٪ با نسبت شانس توسط معادله مرتبط است:
- مجموع موارد=آ+سی=1.962(1+ن)(1لوگاریتم(�آر))2(�آر+2�آر+1�آر)≈15.5(1+ن)(1لوگاریتم(�آر))2
که در آن N نسبت موارد به کنترل است. با نزدیک شدن نسبت شانس به 1، تعداد موارد مورد نیاز برای اهمیت آماری به سمت بی نهایت افزایش می یابد. ارائه مطالعات مورد-شاهدی همه اما بی فایده برای نسبت شانس پایین. به عنوان مثال، برای نسبت شانس 1.5 و موارد = کنترل، جدول نشان داده شده در بالا به شکل زیر است:
| موارد | کنترل ها | |
|---|---|---|
| در معرض دید | 103 | 84 |
| در معرض قرار نگرفته است | 84 | 103 |
برای نسبت شانس 1.1:
| موارد | کنترل ها | |
|---|---|---|
| در معرض دید | 1732 | 1652 |
| در معرض قرار نگرفته است | 1652 | 1732 |
مطالعات کوهورت [ ویرایش ]
مطالعات کوهورت افراد را بر اساس وضعیت قرار گرفتن در معرض آنها انتخاب می کند. آزمودنیهای مطالعه باید در معرض خطر پیامدهای مورد بررسی در ابتدای مطالعه کوهورت باشند. این معمولاً به این معنی است که هنگام شروع مطالعه کوهورت باید عاری از بیماری باشند. گروه در طول زمان دنبال می شود تا وضعیت نتیجه بعدی آنها ارزیابی شود. نمونه ای از یک مطالعه کوهورت، بررسی گروهی از افراد سیگاری و غیرسیگاری در طول زمان برای تخمین بروز سرطان ریه است. همان جدول 2×2 مانند مطالعه مورد شاهدی ساخته شده است. با این حال، تخمین نقطه ای ایجاد شده، خطر نسبی (RR) است، که احتمال بیماری برای یک فرد در گروه در معرض، P e = A / ( A + B ) بیش از احتمال بیماری برای یک فرد در گروه مواجه نشده است. , P u = C / ( C + D )، یعنی RR = P e / P u .
| ….. | مورد | غیر موردی | جمع |
|---|---|---|---|
| در معرض دید | آ | ب | ( A + B ) |
| در معرض قرار نگرفته است | سی | D | ( C + D ) |
مانند OR، RR بزرگتر از 1 ارتباطی را نشان می دهد، که در آن می توان نتیجه گیری را خواند: “کسانی که در معرض قرار گرفتن در معرض قرار گرفتند، احتمال بیشتری برای ابتلا به این بیماری داشتند.”
مطالعات آینده نگر مزایای زیادی نسبت به مطالعات مورد شاهدی دارند. RR یک اندازه گیری اثر قوی تر از OR است، زیرا OR فقط تخمینی از RR است، زیرا بروز واقعی را نمی توان در یک مطالعه مورد شاهدی محاسبه کرد که در آن افراد بر اساس وضعیت بیماری انتخاب می شوند. موقتی بودن را می توان در یک مطالعه آینده نگر ایجاد کرد و عوامل مخدوش کننده به راحتی قابل کنترل هستند. با این حال، آنها پرهزینهتر هستند و بر اساس دوره زمانی طولانی که گروه دنبال میشود، شانس بیشتری برای از دست دادن سوژهها برای پیگیری وجود دارد.
مطالعات کوهورت نیز با معادله یکسانی برای تعداد موارد برای مطالعات کوهورت محدود میشود، اما اگر میزان بروز پایه در جمعیت مورد مطالعه بسیار پایین باشد، تعداد موارد مورد نیاز به میزان 1/2 کاهش مییابد .
استنتاج علی [ ویرایش ]
اگرچه اپیدمیولوژی گاهی اوقات به عنوان مجموعه ای از ابزارهای آماری مورد استفاده برای روشن کردن ارتباط مواجهه با پیامدهای سلامتی در نظر گرفته می شود، درک عمیق تر از این علم، کشف روابط علّی است.
” همبستگی دلالت بر علیت ندارد ” یک موضوع مشترک برای بسیاری از ادبیات اپیدمیولوژیک است. برای اپیدمیولوژیست ها، کلید واژه استنتاج است . همبستگی یا حداقل ارتباط بین دو متغیر، معیاری ضروری اما کافی برای استنباط این است که یک متغیر باعث دیگری می شود. اپیدمیولوژیستها از دادههای جمعآوریشده و طیف وسیعی از نظریههای زیستپزشکی و روانی-اجتماعی به روشی تکراری برای تولید یا بسط نظریه، آزمایش فرضیهها، و اظهارنظرهای آگاهانه و آگاهانه در مورد اینکه کدام روابط علی هستند و دقیقاً چگونه علت هستند، استفاده میکنند.
اپیدمیولوژیست ها تأکید می کنند که درک « یک علت – یک معلول » یک باور غلط ساده انگارانه است. [46] بیشتر پیامدها، چه بیماری و چه مرگ، توسط یک زنجیره یا شبکه متشکل از عوامل متعددی ایجاد میشوند. [47] علل را می توان به عنوان شرایط ضروری، کافی یا احتمالی تشخیص داد. اگر بتوان یک شرایط ضروری را شناسایی و کنترل کرد (مثلاً آنتی بادیها در برابر یک عامل بیماری، انرژی در یک آسیب)، از پیامد مضر میتوان اجتناب کرد (رابرتسون، 2015). یکی از ابزارهایی که به طور منظم برای مفهوم سازی چند علیت مرتبط با بیماری استفاده می شود، مدل پای علی است . [48]
معیارهای برادفورد هیل [ ویرایش ]
در سال 1965، آستین برادفورد هیل مجموعه ای از ملاحظات را برای کمک به ارزیابی شواهد علیت پیشنهاد کرد، [49] که معمولاً به عنوان ” معیارهای برادفورد هیل ” شناخته می شوند . بر خلاف مقاصد صریح نویسنده، ملاحظات هیل اکنون گاهی به عنوان یک چک لیست آموزش داده می شود تا برای ارزیابی علیت اجرا شود. [50] خود هیل میگوید: «هیچ یک از دیدگاههای نه گانه من نمیتواند شواهد غیرقابل انکاری را برای یا علیه فرضیه علت و معلول به ارمغان بیاورد و هیچیک را نمیتوان الزاماً لازم دانست ». [49]
- قدرت تداعی : یک ارتباط کوچک به این معنا نیست که یک اثر علّی وجود ندارد، اگرچه هر چه این ارتباط بزرگتر باشد، احتمال علت و معلولی آن بیشتر است. [49]
- سازگاری داده ها : یافته های ثابت مشاهده شده توسط افراد مختلف در مکان های مختلف با نمونه های مختلف، احتمال یک اثر را تقویت می کند. [49]
- ویژگی : اگر یک جمعیت بسیار خاص در یک مکان خاص و بیماری بدون هیچ توضیح محتمل دیگری وجود داشته باشد، علت محتمل است. هر چه ارتباط بین یک عامل و یک اثر خاص تر باشد، احتمال یک رابطه علّی بیشتر است. [49]
- موقتی : معلول باید بعد از علت اتفاق بیفتد (و اگر تاخیری مورد انتظار بین علت و معلول مورد انتظار باشد، پس معلول باید بعد از آن تاخیر رخ دهد). [49]
- گرادیان بیولوژیکی : قرار گرفتن در معرض بیشتر عموماً باید منجر به بروز بیشتر اثر شود. با این حال، در برخی موارد، صرف حضور عامل می تواند باعث ایجاد اثر شود. در موارد دیگر، نسبت معکوس مشاهده می شود: قرار گرفتن در معرض بیشتر منجر به بروز کمتر می شود. [49]
- معقول بودن : مکانیسم معقول بین علت و معلول مفید است (اما هیل خاطرنشان کرد که دانش مکانیسم توسط دانش فعلی محدود شده است). [49]
- انسجام : انسجام بین یافته های اپیدمیولوژیک و آزمایشگاهی احتمال اثر را افزایش می دهد. با این حال، هیل خاطرنشان کرد که “… فقدان چنین شواهد [آزمایشگاهی] نمی تواند اثر اپیدمیولوژیک روی انجمن ها را باطل کند”. [49]
- آزمایش : “گاهی اوقات می توان به شواهد تجربی متوسل شد”. [49]
- قیاس : ممکن است تأثیر عوامل مشابه در نظر گرفته شود. [49]
تفسیر حقوقی [ ویرایش ]
مطالعات اپیدمیولوژیک فقط میتواند ثابت کند که یک عامل میتوانست در هر مورد خاص، اثری ایجاد کند، اما نه اینکه باعث شده باشد:
اپیدمیولوژی به بروز بیماری در جمعیت ها می پردازد و به سوال علت بیماری یک فرد نمی پردازد. این سؤال که گاهی از آن به عنوان علیت خاص یاد می شود، فراتر از حوزه علم اپیدمیولوژی است. اپیدمیولوژی در نقطه ای که استنباط می شود که رابطه بین یک عامل و یک بیماری علت و معلولی است (علت عمومی) و در جایی که میزان خطر اضافی نسبت داده شده به عامل مشخص شده است، محدودیت های خود را دارد. یعنی اپیدمیولوژی به این موضوع می پردازد که آیا یک عامل می تواند باعث بیماری شود، نه اینکه آیا یک عامل باعث بیماری شاکی خاصی شده است یا خیر. [51]
در قوانین ایالات متحده، اپیدمیولوژی به تنهایی نمی تواند ثابت کند که ارتباط علی به طور کلی وجود ندارد. برعکس، دادگاههای ایالات متحده میتوانند (و در برخی شرایط) در یک پرونده انفرادی، برای توجیه استنباط مبنی بر وجود ارتباط علی، بر اساس توازن احتمالات، اتخاذ کنند .
زیرشاخه اپیدمیولوژی پزشکی قانونی به بررسی علت خاص بیماری یا آسیب در افراد یا گروههایی از افراد در مواردی که در آنها علیت مورد مناقشه یا نامشخص است، برای ارائه در محیطهای قانونی است.
مدیریت سلامت مبتنی بر جمعیت [ ویرایش ]
عملکرد اپیدمیولوژیک و نتایج تجزیه و تحلیل اپیدمیولوژیک کمک قابل توجهی به چارچوب های مدیریت سلامت مبتنی بر جمعیت در حال ظهور است.
مدیریت سلامت مبتنی بر جمعیت شامل توانایی های زیر است:
- ارزیابی وضعیت سلامت و نیازهای بهداشتی یک جمعیت هدف؛
- اجرای و ارزیابی مداخلاتی که برای بهبود سلامت آن جمعیت طراحی شده است. و
- مراقبت کارآمد و مؤثر برای اعضای آن جمعیت به گونه ای که با ارزش های فرهنگی، خط مشی و منابع بهداشتی جامعه سازگار باشد، ارائه دهد.
مدیریت سلامت مبتنی بر جمعیت مدرن پیچیده است و به مجموعهای از مهارتها (پزشکی، سیاسی، فناوری، ریاضی و غیره) نیاز دارد که عملکرد و تجزیه و تحلیل اپیدمیولوژیک جزء اصلی آن است که با علم مدیریت برای ارائه سلامت کارآمد و مؤثر یکپارچه شده است. مراقبت و راهنمایی بهداشتی برای یک جمعیت این وظیفه مستلزم توانایی آینده نگر رویکردهای مدیریت ریسک مدرن است که عوامل خطر سلامت، بروز، شیوع و آمار مرگ و میر (برگرفته از تجزیه و تحلیل اپیدمیولوژیک) را به معیارهای مدیریتی تبدیل می کند که نه تنها نحوه واکنش یک سیستم بهداشتی به مسائل فعلی سلامت جمعیت را راهنمایی می کند. چگونه می توان یک سیستم بهداشتی را برای پاسخگویی بهتر به مسائل بالقوه سلامت جمعیت در آینده مدیریت کرد. [52]
نمونههایی از سازمانهایی که از مدیریت سلامت مبتنی بر جمعیت استفاده میکنند و از کار و نتایج عملکرد اپیدمیولوژیک استفاده میکنند، عبارتند از: استراتژی کانادا برای کنترل سرطان، برنامههای کنترل تنباکو بهداشت کانادا، بنیاد ریک هانسن، ابتکار تحقیقاتی کنترل دخانیات کانادا. [53] [54] [55]
هر یک از این سازمان ها از یک چارچوب مدیریت سلامت مبتنی بر جمعیت به نام زندگی در معرض خطر استفاده می کنند که تجزیه و تحلیل کمی اپیدمیولوژیک را با جمعیت شناسی، تحقیقات عملیاتی آژانس سلامت و اقتصاد ترکیب می کند تا انجام دهد:
- شبیهسازی تأثیرات زندگی جمعیت : اندازهگیری تأثیر احتمالی بیماری در آینده بر جمعیت با توجه به موارد جدید بیماری، شیوع، مرگهای زودرس و همچنین سالهای بالقوه زندگی از دست رفته ناشی از ناتوانی و مرگ.
- شبیهسازی تأثیرات زندگی نیروی کار : اندازهگیری تأثیر احتمالی آینده بیماری بر نیروی کار با توجه به موارد جدید بیماری، شیوع، مرگهای زودرس و سالهای بالقوه زندگی از دست رفته بر اثر ناتوانی و مرگ.
- اثرات اقتصادی شبیه سازی بیماری : اندازه گیری تأثیر بالقوه بیماری در آینده بر تأثیرات درآمد قابل تصرف بخش خصوصی (دستمزدها، سود شرکت ها، هزینه های مراقبت های بهداشتی خصوصی) و تأثیرات درآمد قابل تصرف بخش عمومی (مالیات بر درآمد شخصی، مالیات بر درآمد شرکت ها، مالیات بر مصرف، به طور عمومی هزینه های تامین مالی مراقبت های بهداشتی ).

اپیدمیولوژی میدانی کاربردی
اپیدمیولوژی کاربردی، عمل استفاده از روش های اپیدمیولوژیک برای محافظت یا بهبود سلامت یک جمعیت است. اپیدمیولوژی کاربردی میدانی می تواند شامل بررسی شیوع بیماری های واگیر و غیرواگیر، میزان مرگ و میر و عوارض و وضعیت تغذیه، از جمله سایر شاخص های سلامت، با هدف اطلاع رسانی نتایج به کسانی باشد که می توانند سیاست های مناسب یا اقدامات کنترل بیماری را اجرا کنند.
زمینه بشردوستانه
از آنجایی که نظارت و گزارش بیماری ها و سایر عوامل بهداشتی در شرایط بحران انسانی دشوارتر می شود، روش های مورد استفاده برای گزارش داده ها به خطر افتاده است. یک مطالعه نشان داد که کمتر از نیمی (42.4٪) از نظرسنجی های تغذیه نمونه برداری شده از زمینه های بشردوستانه، شیوع سوء تغذیه را به درستی محاسبه کردند و تنها یک سوم (35.3٪) از نظرسنجی ها معیارهای کیفیت را برآورده کردند. در میان بررسی های مرگ و میر، تنها 3.2٪ معیارهای کیفیت را برآورده کردند. از آنجایی که وضعیت تغذیه و میزان مرگ و میر به نشان دادن شدت یک بحران کمک می کند، ردیابی و گزارش این عوامل بهداشتی بسیار مهم است.
ثبتهای حیاتی معمولاً مؤثرترین راهها برای جمعآوری دادهها هستند، اما در زمینههای بشردوستانه این ثبتها میتوانند وجود نداشته باشند، غیرقابل اعتماد یا غیرقابل دسترسی باشند. به این ترتیب، مرگ و میر اغلب با استفاده از نظارت جمعیتی آینده نگر یا بررسی های گذشته نگر مرگ و میر به طور نادرست اندازه گیری می شود. نظارت جمعیتی آینده نگر به نیروی انسانی زیادی نیاز دارد و اجرای آن در یک جمعیت پراکنده دشوار است. بررسی های گذشته نگر مرگ و میر مستعد سوگیری انتخاب و گزارش است. روشهای دیگری در حال توسعه هستند، اما هنوز روش معمول نیستند.
خصوصیات، اعتبار و تعصب
موج اپیدمی
مفهوم امواج در اپیدمی ها به ویژه برای بیماری های واگیر دار است . یک تعریف کاربردی برای اصطلاح “موج اپیدمی” بر اساس دو ویژگی کلیدی است: 1) شامل دوره هایی از روندهای صعودی یا نزولی است، و 2) این افزایش یا کاهش باید قابل توجه و پایدار در یک دوره زمانی باشد تا از هم متمایز شود. آنها از نوسانات جزئی یا اشتباهات گزارش. [60] استفاده از یک تعریف علمی منسجم برای ارائه یک زبان سازگار است که می تواند برای برقراری ارتباط و درک پیشرفت بیماری همه گیر COVID-19 مورد استفاده قرار گیرد، که به سازمان های مراقبت های بهداشتی و سیاست گذاران در برنامه ریزی و تخصیص منابع کمک می کند.
اعتبار
زمینه های مختلف در اپیدمیولوژی دارای سطوح مختلف اعتبار هستند. یکی از راههای ارزیابی اعتبار یافتهها، نسبت مثبتهای کاذب (اثرات ادعایی که صحیح نیستند) به منفیهای کاذب (مطالعاتی که از یک اثر واقعی پشتیبانی نمیکنند) است. در اپیدمیولوژی ژنتیکی ، مطالعات ژن کاندید ممکن است بیش از 100 یافته مثبت کاذب برای هر یک از موارد منفی کاذب ایجاد کند. در مقابل، ارتباط گسترده ژنوم نزدیک به عکس به نظر می رسد، با تنها یک مثبت کاذب برای هر 100 یا بیشتر منفی کاذب. [61] این نسبت در طول زمان در اپیدمیولوژی ژنتیک بهبود یافته است، زیرا این رشته معیارهای سختگیرانه ای را اتخاذ کرده است. در مقابل، سایر زمینه های اپیدمیولوژیک به چنین گزارش دقیقی نیاز ندارند و در نتیجه بسیار کمتر قابل اعتماد هستند.
خطای تصادفی
خطای تصادفی نتیجه نوسانات حول یک مقدار واقعی به دلیل تنوع نمونه است. خطای تصادفی فقط همین است: تصادفی. این می تواند در طول جمع آوری داده ها، کدگذاری، انتقال یا تجزیه و تحلیل رخ دهد. نمونههایی از خطاهای تصادفی عبارتند از: سؤالهایی با واژهبندی ضعیف، سوء تفاهم در تفسیر پاسخ فردی از یک پاسخدهنده خاص، یا اشتباه تایپی در هنگام کدنویسی. خطای تصادفی اندازه گیری را به صورت گذرا و متناقض تحت تأثیر قرار می دهد و تصحیح خطای تصادفی غیرممکن است. یک خطای تصادفی در تمام مراحل نمونه گیری وجود دارد – خطای نمونه گیری .
دقت در متغیرهای اپیدمیولوژیک معیاری برای خطای تصادفی است. دقت نیز با خطای تصادفی رابطه معکوس دارد، به طوری که کاهش خطای تصادفی افزایش دقت است. فواصل اطمینان برای نشان دادن دقت برآوردهای ریسک نسبی محاسبه می شود. هرچه فاصله اطمینان کمتر باشد، تخمین ریسک نسبی دقیق تر است.
دو راه اساسی برای کاهش خطای تصادفی در یک مطالعه اپیدمیولوژیک وجود دارد . اولین مورد افزایش حجم نمونه مطالعه است. به عبارت دیگر، موضوعات بیشتری را به مطالعه خود اضافه کنید. دوم کاهش تنوع در اندازه گیری در مطالعه است. این ممکن است با استفاده از یک دستگاه اندازه گیری دقیق تر یا با افزایش تعداد اندازه گیری ها انجام شود.
توجه داشته باشید که اگر حجم نمونه یا تعداد اندازهگیریها افزایش یابد یا ابزار اندازهگیری دقیقتری خریداری شود، معمولاً هزینههای مطالعه افزایش مییابد. معمولاً بین نیاز به دقت کافی و مسئله عملی هزینه مطالعه تعادل نامطلوب وجود دارد.
خطای سیستماتیک
یک خطای سیستماتیک یا سوگیری زمانی رخ می دهد که بین مقدار واقعی (در جامعه) و مقدار مشاهده شده (در مطالعه) از هر علتی غیر از تنوع نمونه گیری تفاوت وجود داشته باشد. یک مثال از خطای سیستماتیک این است که، برای شما ناشناخته، پالس اکسی متری که استفاده می کنید اشتباه تنظیم شده باشد و هر بار که اندازه گیری می شود دو نقطه به مقدار واقعی اضافه می کند. دستگاه اندازه گیری می تواند دقیق باشد اما دقیق نیست . از آنجا که خطا در هر موردی اتفاق می افتد، سیستماتیک است. نتیجه گیری هایی که بر اساس آن داده ها می گیرید همچنان نادرست خواهند بود. اما خطا را می توان در آینده تکرار کرد (مثلاً با استفاده از همان ابزار تنظیم اشتباه).
یک اشتباه در کدنویسی که بر پاسخهای آن سؤال خاص تأثیر میگذارد ، نمونه دیگری از خطای سیستماتیک است.
اعتبار یک مطالعه به میزان خطای سیستماتیک بستگی دارد. اعتبار معمولاً به دو جزء تقسیم می شود:
- اعتبار داخلی به میزان خطا در اندازه گیری ها، از جمله مواجهه، بیماری و ارتباط بین این متغیرها بستگی دارد. اعتبار درونی خوب حاکی از عدم وجود خطا در اندازه گیری است و نشان می دهد که ممکن است استنباط هایی حداقل در رابطه با موضوعات مورد مطالعه باشد.
- اعتبار خارجی مربوط به فرآیند تعمیم یافته های مطالعه به جامعه ای است که نمونه از آن استخراج شده است (یا حتی فراتر از آن جامعه به یک بیانیه جهانی تر). این مستلزم درک این است که کدام شرایط با تعمیم مرتبط (یا نامربوط) هستند. روایی درونی به وضوح پیش نیاز اعتبار خارجی است.
سوگیری انتخاب
سوگیری انتخاب زمانی اتفاق میافتد که افراد مورد مطالعه در نتیجه یک متغیر سوم و اندازهگیری نشده انتخاب شوند یا بخشی از مطالعه شوند که هم با مواجهه و هم با نتیجه مورد علاقه مرتبط است. [62] برای مثال، بارها اشاره شده است که افراد سیگاری و غیرسیگاری تمایل به تفاوت در میزان مشارکت در مطالعه دارند. (Sackett D مثالی از Seltzer و همکاران را ذکر می کند، که در آن 85٪ از افراد غیر سیگاری و 67٪ از افراد سیگاری پرسشنامه های پستی را برگرداندند.) [63] توجه به این نکته مهم است که چنین تفاوتی در پاسخ منجر به سوگیری نخواهد شد. همچنین با تفاوت سیستماتیک در نتیجه بین دو گروه پاسخ همراه نیست.
سوگیری اطلاعات
سوگیری اطلاعاتی سوگیری ناشی از خطای سیستماتیک در ارزیابی یک متغیر است. [64] نمونه ای از این سوگیری یادآوری است. یک مثال معمولی دوباره توسط ساکت در بحث خود در مورد مطالعهای ارائه شده است که به بررسی تأثیر مواجهههای خاص بر سلامت جنین میپردازد: «در سؤال از مادرانی که حاملگیهای اخیرشان به مرگ جنین یا ناهنجاری ختم شده است (موارد) و گروه مشابهی از مادرانی که حاملگی آنها به پایان رسیده است. به طور معمول (کنترل) مشخص شد که 28٪ از اولی، اما فقط 20٪ از دومی، قرار گرفتن در معرض داروهایی را گزارش کردند که نمیتوان آن را در مصاحبههای آینده نگر قبلی یا سایر پروندههای بهداشتی اثبات کرد. [63] در این مثال، سوگیری یادآوری احتمالاً در نتیجه زنانی رخ داده است که سقط جنین داشته اند و تمایل آشکاری به یادآوری بهتر دارند و بنابراین در معرض قرار گرفتن قبلی خود گزارش می دهند.
گیج کننده
مداخله گر به طور سنتی به عنوان سوگیری ناشی از وقوع همزمان یا اختلاط اثرات عوامل خارجی که به عنوان مخدوش کننده نامیده می شوند، با اثر(های) اصلی مورد علاقه، تعریف شده است. [64] [65] یک تعریف جدیدتر از مخدوش کردن مفهوم اثرات خلاف واقع را فرا می خواند . [65] طبق این دیدگاه، هنگامی که فرد یک نتیجه مورد علاقه را مشاهده میکند، مثلاً Y=1 (در مقابل Y=0)، در یک جمعیت معین A که کاملاً در معرض دید قرار میگیرد (یعنی مواجهه X = 1 برای هر واحد جمعیت ) خطر این رویداد R A1 خواهد بود . خطر خلاف واقع یا مشاهده نشده R A0 مطابق با خطری است که اگر همین افراد در معرض خطر قرار نگرفته بودند مشاهده می شد (یعنی X = 0 برای هر واحد جمعیت). بنابراین اثر واقعی قرار گرفتن در معرض این است: R A1 – R A0 (اگر کسی به تفاوت ریسک علاقه دارد) یا R A1 / R A0 (اگر به ریسک نسبی علاقه دارد). از آنجایی که ریسک خلاف واقع R A0 قابل مشاهده نیست، آن را با استفاده از یک جمعیت دوم B تقریب می زنیم و در واقع روابط زیر را اندازه گیری می کنیم: R A1 – R B0 یا R A1 / R B0 . در این شرایط، مخدوش شدن زمانی رخ می دهد که R A0 ≠ R B0 . [65] (نکته: به عنوان مثال، متغیرهای باینری نتیجه و مواجهه را فرض میکند.)
برخی از اپیدمیولوژیست ها ترجیح می دهند به مخدوش کردن جدا از دسته بندی های رایج سوگیری فکر کنند، زیرا برخلاف سوگیری انتخاب و اطلاعات، گیج کننده از اثرات علی واقعی ناشی می شود.
حرفه
تعداد کمی از دانشگاه ها اپیدمیولوژی را به عنوان دوره تحصیلی در مقطع کارشناسی ارائه کرده اند. یک برنامه قابل توجه در مقطع کارشناسی در دانشگاه جانز هاپکینز وجود دارد ، جایی که دانشجویانی که در رشته بهداشت عمومی تحصیل می کنند می توانند دوره های تحصیلات تکمیلی، از جمله اپیدمیولوژی را در طول سال آخر خود در دانشکده بهداشت عمومی بلومبرگ بگذرانند .
اگرچه تحقیقات اپیدمیولوژیک توسط افرادی از رشته های مختلف، از جمله متخصصان بالینی آموزش دیده مانند پزشکان انجام می شود، آموزش رسمی از طریق برنامه های کارشناسی ارشد یا دکترا از جمله کارشناسی ارشد بهداشت عمومی (MPH)، کارشناسی ارشد علوم اپیدمیولوژی (MSc.)، دکترای عمومی در دسترس است. بهداشت (DrPH)، دکترای داروسازی (PharmD)، دکترای فلسفه (PhD)، دکترای علوم (ScD). بسیاری از برنامه های فارغ التحصیل دیگر، به عنوان مثال، دکترای مددکاری اجتماعی (DSW)، دکترای بالینی (DClinP)، دکترای پزشکی پا (DPM)، دکترای دامپزشکی (DVM)، دکترای پرستاری (DNP)، دکترای فیزیکی درمان (DPT)، یا برای پزشکان آموزش دیده بالینی، دکترای پزشکی (MD) یا لیسانس پزشکی و جراحی (MBBS یا MBChB) و دکترای پزشکی استئوپاتیک (DO)، شامل برخی آموزش ها در تحقیقات اپیدمیولوژیک یا موضوعات مرتبط است، اما این آموزش به طور کلی بسیار کمتر از آنچه در برنامه های آموزشی متمرکز بر اپیدمیولوژی یا بهداشت عمومی ارائه می شود. با انعکاس پیوند تاریخی قوی بین اپیدمیولوژی و پزشکی، برنامه های آموزشی رسمی ممکن است در دانشکده های بهداشت عمومی یا دانشکده های پزشکی تنظیم شود.
به عنوان پزشکان بهداشت عمومی/حفاظت از سلامت، اپیدمیولوژیست ها در تعدادی از تنظیمات مختلف کار می کنند. برخی از اپیدمیولوژیست ها “در میدان” کار می کنند. به عنوان مثال، در جامعه، معمولا در خدمات بهداشت عمومی/حفاظت بهداشتی، و اغلب در خط مقدم بررسی و مبارزه با شیوع بیماری هستند. سایرین برای سازمانهای غیرانتفاعی، دانشگاهها، بیمارستانها و نهادهای دولتی بزرگتر مانند ادارات بهداشت ایالتی و محلی، وزارتخانههای مختلف بهداشت، پزشکان بدون مرز ، مراکز کنترل و پیشگیری از بیماریها (CDC)، آژانس حفاظت از سلامت ، جهان کار میکنند. سازمان بهداشت (WHO)، یا آژانس بهداشت عمومی کانادا . اپیدمیولوژیست ها همچنین می توانند در سازمان های انتفاعی مانند شرکت های داروسازی و تجهیزات پزشکی در گروه هایی مانند تحقیقات بازار یا توسعه بالینی کار کنند.
COVID-19
مقاله ای در آوریل 2020 دانشگاه کالیفرنیای جنوبی اشاره کرد که ” اپیدمی کروناویروس … اپیدمیولوژی – مطالعه بروز، توزیع و کنترل بیماری در یک جمعیت – را به خط مقدم رشته های علمی در سراسر جهان سوق داد و حتی افراد مشهور را به طور موقت معرفی کرد. برخی از تمرینکنندگان آن.” [67]
همچنین ببینید
- تنظیم سن – تکنیکی که برای مقایسه جمعیت ها با پروفایل های سنی مختلف استفاده می شود
- مطالعه بیماری قلبی Caerphilly – پروژه تحقیقاتی پزشکی
- مرکز تحقیقات اپیدمیولوژی بلایای طبیعی ( CRED )
- Centro Studi GISED
- طرح گردش
- ردیابی تماس – یافتن و شناسایی افراد در تماس با فرد مبتلا به یک بیماری عفونی
- اندازه جامعه بحرانی – حداقل اندازه یک جمعیت بسته که در آن یک پاتوژن می تواند به طور نامحدود باقی بماند.
- خوشه بیماری – بروز زیاد یک وضعیت پزشکی در یک مکان یا بازه زمانی خاص
- نقشه انتشار بیماری – نقشه خطر بیماری برای یک منطقه
- مدلهای تقسیمی در اپیدمیولوژی – نوع مدل ریاضی مورد استفاده برای بیماریهای عفونی
- روش اپیدمیولوژیک – روش علمی در زمینه خاص
- انتقال اپیدمیولوژیک – اصطلاح در جمعیت شناسی و جغرافیای پزشکی کشورهای در حال توسعه به ویژه، مربوط به جمعیت مسن تر
- مرکز اروپایی پیشگیری و کنترل بیماری – آژانس اتحادیه اروپا
- پارادوکس اسپانیایی – یافته اپیدمیولوژیک
- انجمن بین المللی فارماکوپیدمیولوژی
- ماتریس قرار گرفتن در معرض شغل – ابزاری برای تخمین سابقه قرار گرفتن در معرض شغلی یک فرد
- مدلسازی ریاضی بیماریهای عفونی – استفاده از مدلهای ریاضی برای درک انتقال بیماریهای عفونی
- تصادفی سازی مندلی – روش آماری در اپیدمیولوژی ژنتیک
- اپیدمیولوژی شغلی – اپیدمیولوژی بیماری های محل کار
- تجزیه و تحلیل پیش بینی – تکنیک های آماری تجزیه و تحلیل حقایق برای پیش بینی در مورد رویدادهای ناشناخته
- انجمن روانشناسی بهداشت حرفه ای – سازمان روانشناسی بهداشت حرفه ای آمریکا
- گروه های جمعیتی در زیست پزشکی – سلامت بر اساس هویت نژادی
- اپیدمیولوژی فضایی – زیر شاخه جغرافیای سلامت با تمرکز بر مطالعه توزیع فضایی پیامدهای سلامت
- مطالعه سلامت در پومرانیا
- استراتژی های ایمن سازی هدفمند
- برنامه ریزی شهری – فرآیند فنی و سیاسی مربوط به استفاده از زمین و طراحی محیط شهری
- مطالعه وایت هال – مطالعه بهداشتی کارمندان دولت بریتانیا
- زئونوزیس – بیماری که می تواند از گونه های دیگر به انسان منتقل شود
